氮素是作物生长发育不可缺少的多量元素之一,是提高作物产量和改善品质的重要营养元素,在作物生产中具有极其重要的作用。棉花是我国重要的经济作物,又是需氮量很大的作物,近年,随着人们对棉花产量需求的提高,化学氮肥的施用量也急剧增加,而氮肥的利用率却不断下降。吕殿青等(1998)研究表明,我国氮肥的平均利用率仅为30%~35%。氮肥利用率低不但加大了棉花生产成本,造成氮肥资源的巨大浪费,而且还导致地下水的污染和地表水的富营养化,对生态环境产生了严重的负面影响,阻碍了棉花生产健康可持续发展。
高亲和NO3-转运蛋白(NRT2)在结构上属于硝酸盐-亚硝酸盐共转运蛋白家族,NRT2的C端,N端和亲水结构域都位于胞质一侧,对于NRT2的研究,Trueman等(1996)第一次从大麦中克隆了作物。NRT2基因编码的蛋白都呈现相似的结构特征,分子大小在54~65 kD。具有12个跨膜域。作物吸收的氮素主要是无机态氮,包括硝态氮(NO3-)和铵态氮(NH4+)两种。张维理等(1995)植物通过根系吸收,将硝态氮和铵态氮由体外转入体内是氮素代谢的第一步,它不仅受外界环境的影响,同时也受植物自身内在因素的影响。研究表明,作物根系对土壤中NO3-和NH4+的吸收和它们在植株器官、组织中的转运是由位于细胞原生质膜氮素转运蛋白介导来完成的。植物中氮素转运蛋白在改善植物氮胁迫条件下的氮素吸收和利用效率具有重要作用。因此,利用基因工程克隆棉花硝酸盐高亲和转运蛋白基因,并通过转基因技术培育棉花氮高效品种,对减少氮的浪费,提高氮的利用率具有十分重要的意义。
李加瑞等(2005) RNAi是指小的双链RNA (double-strandedds RNA)阻碍生物体内特定基因表达,使mRNA降解,使特定基因失活细胞表现出缺陷表型的过程。自RNA干扰(RNA interference, RNAi)技术诞生以来,该技术得到迅速发展,为作物品质改良提供了新技术,已在Pinto等(1999)水稻、Abbott等(2000)小麦, Subramanian等(2005)大豆等多种作物的品质,抗逆改良中得到成功应用。
NRT2基因在水稻等作物中得到较好的利用,而对于棉花至今还没有相关的研究报道,利用分子生物学方法克隆棉花硝酸盐高亲和转运蛋白基因片断,以此为靶基因构建了棉花NRT2基因的RNA干扰表达载体,为进一步研究该基因的功能奠定一定的基础。
1结果与分析
1.1棉花总RNA的提取
用CTAB法,提取低氮胁迫处理的棉花根部的总RNA。经分光光度计测定OD260/OD280=1.80~2.00,OD260/OD280=2.00~2.35,琼脂糖凝胶电泳检测显示,28S rRNA的亮度约为18S rRNA的两倍(图1),说明mRNA质量良好,符合实验所需。
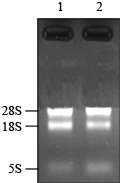
图1 棉花根部总RNA琼脂糖凝胶电泳
Figure 1 Cotton root total RNA agarose gel electrophoresis |
1.2正反向目的片段的克隆与鉴定
将提取的总RNA反转录成cDNA,分别用正反向引物扩增目的片段,扩增产物经凝胶电泳检测,与预期一致,获得长约350 bp的两条DNA片段(图2)。将正反向片段分别克隆到pGEM-T载体上,各挑取PCR鉴定正确的两个阳性克隆进行测序,测序得到正反向序列大小均为 350 bp,经DNAman比对与蓖麻的同源性为80%,与杨树的同源性为79%。
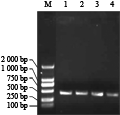
图2 NRT2正向序列NRT2w与反向重复序列NRT2v的扩增产物
Figure 2 NRT2 forward and reverse repeat sequences NRT2w and NRT2v of amplification products and sequences (Here is the sequence obtained from fragments) |
1.3中间载体的构建
将正向克隆的质粒pGEM-NRT2w经SacⅠ和NcoⅠ完全双酶切后,获得约350 bp的条带(图3C, 泳道1所示),回收该片段。pUCM-T质粒经SacⅠ和NcoⅠ双酶切后,得到开环的载体骨架(图3B, 泳道1和泳道2所示),大小约为2 773 bp,将其回收。正向片段NRT2w与开环骨架pUCM-T连接得到重组子pUCM-NRT2A,将其转化DH5α,进行PCR和酶切检测,得到350 bp的条带(图3A, 泳道1所示; 图3C, 泳道3所示),进一步经测序进行确认,说明正义片段已经按正确方向插入到启动子与间隔区之间,形成了中间载体pUCM-NRT2A。
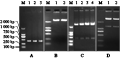
图3 RNAi载体pUCM-NRT2B构建中的酶切和PCR鉴定
Figure 3 RNAi plasmid pUCM-NRT2B digestion and PCR identification in the built |
采用XbaⅠ和XhoⅠ分别对NRT2v的质粒和重组子pUCM-NRT2A进行双酶切,前者产生了约350 bp目的片段(图3C, 泳道2所示),后者产生了约3 100 bp的开环骨架(图3C, 泳道4所示),分别将两者回收,连接重组,得到干扰载体pUCM-NRT2B,转化DH5α,进行PCR和酶切检测,分别得到350 bp和1 200 bp左右的条带(图3A, 泳道2和泳道3所示; 图3D, 泳道1和泳道2所示),说明pUCM-NRT2B干扰载体构建成功。
1.4 RNAi表达载体构建及鉴定
将重组子pUCM-NRT2B和pPZP35S分别用SacⅠ和XbaⅠ酶进行双酶切,分别回收pPZP35S大片段和重组子pUCM-NRT2B的目的片段,将两者连接,得到干扰表达载体pPZP35S-NRT2B。将构建好的干扰载体通过电击法转入农杆菌GV3101中,对转化菌落提取质粒并以(表1)中的引物进行PCR验证,分别得到350 bp左右的片段(图4)。PCR检测结果显示已成功构建了具有pPZP35S-NRT2B表达框架的植物载体(图5),构建的RNAi载体已进行了烟草叶片转染,鉴定正在等待之中。

表1 干扰载体正向与反向重复序列的引物序列
Table 1 Interference plasmid with the forward and reverse primers Sequence |
.png)
图4 转化农杆菌的PCR验证
Figure 4 Agrobacterium transformation of the PCR verification |
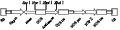
图5 pPZP35S-NRT2B表达框架结构示意图
Figure 5 pPZP35S-NRT2B expression framework diagram |
2讨论
RNA 干扰是真核细胞本身固有的生理发展调节机制和对抗外源基因及其侵害的一种自我保护现象,在利用RNA干扰引发的基因沉默当中,效率要比传统的反义RNA诱导的基因沉默高得多,并且能够稳定表达,这使得RNA干扰技术成为抑制基因表达的高效可靠的技术。近年来,朱见明等(2011) RNAi技术广泛应用于基因功能的分析验证,构建合适的载体是RNAi的关键,本研究所构建的RNA干扰表达载体是含GUS内含子的一种发夹结构,具有较高的干扰效率,是目前研究的热点。Napoli等(1990)利用RNA干扰技术证证明了RNAi对大豆子叶中IFS基因的功能作用。李小平等采用RNA 干扰技术证明了大豆叶片衰老与大豆LRP型类受体蛋白激酶基因rlpk2有关。Hirotaka等(2006)利用RNA干扰技术表明了豆科植物根瘤素合成基因ENOD40对根瘤的出现和生长是必需的。
徐海荣等(2007) NO3-转运蛋白基因已在水稻,小麦,蓖麻,杨树等植物中获得克隆,但在棉花中还没报道,在植物体内的表达具有组织特异性,NRT2家族成员多具有器官和组织的特异性,有些基因的表达还受到植物生长和发育状况的影响,植物中的很多NO2-转运蛋白基因优先在根部表达。杜培粉等(2009)如烟草和拟南芥,其中烟草的叶片,叶柄,芽,花及种子中只检测到了微量的NRT2基因的表达,拟南芥的NRT2基因在茎中的表达量仅为根部的1%。高亲和氮高效基因NRT家族不仅具有运输NO3-,而且具有运输氨基酸,氯酸盐的作用。此外NRT家族成员还参与作物生长,发育的调节。
选择合适当的片段是RNAi载体构建关键因素。魏海燕等(2008)研究表明,基因片段大小在23~1 kb都能得到理想的干扰效果。Wesley等(2001)还有研究表明,干扰片段的长度对基因干涉效有影响,干扰片段在50~500 bp之间,随着片段大小的增加,干扰效率提高。陈新等(2007)基因片段太短构建操作困难,而且过短的dsRNA很难被DICER酶识别;过长的基因片段在构建载体操作中很容易引起片段重组,并且太长的dsRNA结构本身不稳定。因此,最佳基因片段大小应该在200~600 bp左右,利于转化验证和外源基因在转基因植株中的稳定遗传。所以,本研究设计选取350 bp的干扰片段,目的是有效抑制靶标基因的表达。
本研究构建了硝酸盐高亲和转运蛋基因的RNA干扰载体,以正向和反向重复序列插入到中间载体pUCM-T的内含子两端,利用pPZP35S作为桥梁载体,成功构建RNA干涉表达载体pPZP35S-NAR2B。下一步工作将通过农杆菌介导法将植物表达载体pPZP35S-NAR2B转入到烟草中,利用RT-PCR快速检测其对硝酸盐高亲和转运蛋基因的的干扰效果,如得到较好的干扰效果将进一步探索在棉花植株上诱导RNAi的条件。
3材料与方法
3.1实验材料
3.1.1植物材料
新陆早12号(由石河子大学农学院育种教研室提供)采用水培(霍格兰营养液)方法,待棉花幼苗长至三叶一心时进行低氮(0.2 mmol/L)胁迫处理4 h后取棉花根部,液氮速冻后于-80℃保存。
3.1.2菌株和载体
大肠杆菌菌株(Escherichia coli) DH5α,根瘤农杆菌菌株(Agrobacterium tumefaciens) GV3101,含有GUS的内含子序列的中间载体pUCM-T由园艺系实验室惠赠,植物表达载体pPZP35S由石河子大学绿洲生态作物分子生物学实验室保存。
3.1.3试剂
限制性内切酶SacⅠ,NcoⅠ,XbaⅠ,XhoⅠ,Taq DNA聚合酶,T4DNA连接酶购自TaKaRa公司,胶回收试剂盒购自Tiangen公司,其他生化试剂均为国产分析纯。
3.1.4引物设计及合成
根据蓖麻和杨树的NRT2基因保守序列,并通过软件分析酶切位点,设计两对引物(表1)。
3.2方法
3.2.1目的片断的克隆及序列测定
用CTAB法提取棉花根部总RNA,用TIANScript cDNA第一链合成试剂盒反转录成cDNA,以反转录的cDNA为模板,分别用正反向目的片段的引物,通过RT-PCR方法扩增得到棉花高亲和硝酸盐转运蛋白基因的正向序列NRT2w和反向重复序列NRT2v 的目的片段,反应程序:94℃预变性4 min;94℃变性1 min;54℃退火45 s;72℃延伸45 s,25个循环;72℃延伸10 min。将获得的基因片段连接pGEM-Teasy载体并转化大肠杆菌DH5α。经菌液PCR鉴定和酶切鉴定正确后,挑取2个阳性克隆,送上海生工生物工程技术服务有限公司测序。
3.2.2棉花NRT2基因RNA干扰载体的构建
用正向克隆的质粒pGEM-NRT2w和pUCM-T的质粒,进行SacⅠ和NcoⅠ的双酶切至完全,电泳后回收正向片段和开环的pUCM-T骨架,采用T4DNA连接酶将两者于4℃连接过夜,得到重组子pUCM-NRT2A,转化DH5α,PCR鉴定和酶切鉴定筛选阳性克隆。
采用XbaⅠ和XhoⅠ分别对重组子pUCM-NRT2A和反向克隆的质粒pGEM-NRT2v进行完全双酶切,电泳后回收pUCM-NRT2A和反向片段,采用T4DNA连接酶将两者于4℃连接过夜,得到重组子pUCM-NRT2B,转化DH5α,PCR鉴定和酶切鉴定筛选阳性克隆,阳性克隆即为棉花NRT2基因的RNA干扰载体。
3.2.3 RNAi表达载体在农杆菌中的转化与鉴定
从鉴定无误的大肠杆菌中提取重组子的质粒,将得到的重组质粒用SacⅠ和xbaⅠ双酶切,切下含正向序列、反向重复序列和内含子间隔序列的目标片段,并进行回收。再用SacⅠ和XbaⅠ双酶切质粒pPZP35S,回收大片段。将目标片段与回收的pPZP35S载体大片段用T4DNA连接酶在4℃下连接过夜,转化筛选阳性克隆即得RNA干扰载体pPZP35S-NRT2B。利用电击法将重组质粒pPZP35S-NRT2B转化到农杆菌GV3101中,将菌液涂布于TYE (20 μg/mL Rifa+50 μg/mL Kna)固体培养基中,于28℃条件下培养2 d,挑取单菌落进行PCR检测。
作者贡献
郑丽玲、张伟和张薇是本研究的主要执行人;郑丽玲,张伟完成数据分析,论文初稿的写作;李艳军,马玲玲和魏延宏参与实验设计,试验结果分析;张薇是项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由石河子大学科学技术研究发展计划“动植物育种专项计划项目”转基因专项子专(2008ZX08005-005)资助。作者感谢石河子大学李艳军老师在本实验过程中的技术支持和有益的建议。感谢两位匿名的同行评审人的评审建议和修改建议。本文中提到了我们实验中涉及的有关试剂供应商和测序服务商,这并非我们为这些试剂供应商和测序服务商的产品和服务提供推荐或背书。
参考文献
Abbott D.C., Wang M.B., and Waterhouse P.M., 2000, A single copy of a virus-derived transgene-encoding hairp in RNA gives immunity to barley yellow dwarf virus, Molecular Plant Pathology, 1(6): 347-356 http://dx.doi.org/10.1046/j.1364-3703.2000.00038.x
Chen X., Liu Q.Z., Li Y.X., Lv H.Z., Liang Y.Q., Zhang S.G., Shao J.P., and Zhang Y.H., 2007, RNAi expression vector construction of α-farnesene synthase gene from Yali Pear (Pyrus breschneideri Rehd), Shengwu Jishu Tongxun (Lett Biotechnologe), 18(5): 786-788 (陈新, 刘庆忠, 李杨昕, 吕慧贞, 梁雅芹, 张士刚, 邵建萍, 张元湖, 2007, 鸭梨一法尼烯合成酶基因双链RNAi表达载体的构建, 生物技术通讯, 18(5): 786-788)
Du P.F., Wu L.T., Yao Y.T., Yi F., Ruan Y., and Liu C.L., 2009, Construction of the RNAi Vector of AtTPS03 gene and Arbidopsis Transformation, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 7(3): 451-455 (杜培粉, 伍林涛, 姚远颋, 尹峰, 阮颖, 刘春林, 2009, AtTPS03基因RNA干扰载体的构建及拟南芥转化, 分子植物育种, 7(3): 451-455)
Hirotaka K., Eri K., Robert W.R., and Hiroshi K., 2006, RNAi knock-down of ENOD40s leads to significant suppression of nodule formation in Lotus japonicus, Plant Cell Physiol., 47(8): 1102-1111 http://dx.doi.org/10.1093/pcp/pcj081
Li J.R., Zhao W., Li Q.Z., Ye X.G., An B.Y., Li X., and Zhang X.S., 2005, RNA silencing of Waxy gene results in low leve is of Aamylose in the seeds of Trans genic wheat (Triticumaes tivum L.), Yichuan Xuebao (Genetics), 32(8): 846-854 (李加瑞, 赵伟, 李全梓, 叶兴国, 安宝燕, 李祥, 张宪省, 2005, Waxy基因的RNA沉默使转基因小麦种子中直链淀粉含量下降, 遗传学报, 32(8): 846-854)
Lv D.Q, Tong Y.A., and Sun B.H., 1998, Study on effect of nitrogen fertilizer use on environment pollution, Zhiwu Yingyang Yu Feiliao Xuebao (Plant Nutrition and Fertilizer Science), 4(1): 8-15 (吕殿青, 同延安, 孙本华, 1998, 氮肥施用对环境污染影响的研究, 植物营养与肥料学报, 4(1): 8-15)
Napoli C., Lemieux C., and Jorgensen R., 1990, Introduction of a chimeric chalcone synthase gene into petunia results in reversible co-suppression of homologous genes in trans, Plant Cell, 2(4): 279-289 http://dx.doi.org/10.1105/tpc.2.4.279 http://dx.doi.org/10.2307/3869076
Pinto Y.M., Kok R.A., and Bandcombe D.C., 1999, Resistance to rice yellow mottle virus (RYMV) in cultivated African rice varieties containing RYMV transgenes, Nature Biotechnology, 17(7): 702-707 http://dx.doi.org/10.1038/10917
Subramanian S., Graham M.Y., Yu O., and Graham T.L., 2005, RNA interference of soybean isoflavone synthase genes leads to silencing in tissues distal to the transformation site and enhanced susceptibility to Phytophthora sojae, Plant Physiol., 137(4): 1345-1353 http://dx.doi.org/10.1104/pp.104.057257
Trueman L.J., Richardson A., and Forde B.G., 1996, Molecular cloning of higher plant homologues of the high-affinity nitrate transporters of Chlamydomonas rein hardti and Aspergillus nidulans, Gene, 175(1-2): 223-231 http://dx.doi.org/10.1016/0378-1119(96)00154-0
Wei H.Y., Zhang H.C., Hang J., Dai Q.G., Huo Z.Y., Xu K., Zhang S.F., Ma Q., Zhang Q., and Zhang J., 2008, Characteristics of N accumulation and translocation in rice Geno-types with different N use efficiencies, Zuowuxue Bao (Acta Agronomica Sinica), 34(1): 119-125 (魏海燕, 张洪程, 杭杰, 戴其根, 霍中洋, 许轲, 张胜飞, 马群, 张庆, 张军, 2008, 不同氮素利用效率基因型水稻氮素积累与转移的特性, 作物学报, 2008, 34(1): 119-125)
Wesley S.V., Helliwell C.A., Smith N.A., Wang M.B., Rouse D.T., Liu Q., Gooding P.S., Singh S.P., Abbott D., Stoutjesdijk P.A., Robinson S.P., Gleave A.P., Green A.G., and Waterhouse P.M., 200l,. Construct design for efficient, effective and high-throughput gene silencing in plants, Plant J., 27(6): 581-590 http://dx.doi.org/10.1046/j.1365-313X.2001.01105.x
Xu H.R., Deng R.L., Cao Y.F., and Xiao K., 2007, Structure, function, expression, and regulation of nitrate transporters in plants, Caoye Xuebao (Acta Prataculturae Sinica), 17(4): 159-165 (徐海荣, 邓若磊, 曹云飞, 肖凯, 2007, 植物N03-转运蛋白的结构, 功能及基因表达调控, 草业学报, 17(4): 159-165)
Zhang W.L., Tian Z.X., Zhang N., and Li X.Q., 1995, Investigation of nitrate pollution in ground water due to nitrogen fertilization in agriculture in north China, Zhiwu Yingyang Yu Feiliao Xuebao (Plant Nutrition and Fertilizer Science), 1(2): 80-87 (张维理, 田哲旭, 张宁, 李晓齐, 1995, 我国北方农用氮肥造成地下水硝酸盐污染的调查, 植物营养与肥料学报, 1(2): 80-87)
Zhu J.M., Yan X.B., Shi Y.H., and Wang C.Z., 2011, Cloning of Medicago sativa phychrome B cDNA and establishment of its RNA interference expression vector, Zuowu Xuebao (Acta Agronomica Sinica), 37(2): 374-379 (朱见明, 严学兵, 史莹华, 王成章, 2011, 紫花苜蓿光敏色素B基因片段克隆及RNA干扰表达载体的构建, 作物学报, 37(2): 374-379)
 作者
作者  通讯作者
通讯作者



![]()
.png)
![]()